Uma nova forma de combater o câncer
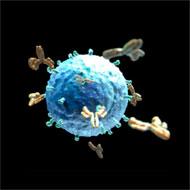 Anticorpos são proteínas usadas pelo sistema imunológico para identificar e neutralizar corpos estranhos como bactérias, vírus ou células tumorais. Também conhecidos como Imunoglobulinas (Ig), os anticorpos são produzidos e secretados por linfócitos B, em resposta à presença de antígenos. Os antígenos são moléculas alvo dos anticorpos, que apresentam diferentes estruturas químicas e podem estimular a ativação do sistema imune, quando relacionados a organismos estranhos. Cada anticorpo produzido reconhece um epítopo ou porção específica do antígeno. A especificidade entre as moléculas determinará a afinidade ou força de interação entre elas. Essa especificidade também garante uma ação mais precisa sobre o alvo, uma vez que, por meio desta interação antígeno-anticorpo, microrganismos podem ser diretamente neutralizados ou ainda serem atacados por outros componentes do sistema imunológico que passam a reconhecê-los.
Anticorpos são proteínas usadas pelo sistema imunológico para identificar e neutralizar corpos estranhos como bactérias, vírus ou células tumorais. Também conhecidos como Imunoglobulinas (Ig), os anticorpos são produzidos e secretados por linfócitos B, em resposta à presença de antígenos. Os antígenos são moléculas alvo dos anticorpos, que apresentam diferentes estruturas químicas e podem estimular a ativação do sistema imune, quando relacionados a organismos estranhos. Cada anticorpo produzido reconhece um epítopo ou porção específica do antígeno. A especificidade entre as moléculas determinará a afinidade ou força de interação entre elas. Essa especificidade também garante uma ação mais precisa sobre o alvo, uma vez que, por meio desta interação antígeno-anticorpo, microrganismos podem ser diretamente neutralizados ou ainda serem atacados por outros componentes do sistema imunológico que passam a reconhecê-los.
Interessantemente, células tumorais produzem diferentes tipos de antígenos imunogênicos, que desencadeiam a ativação do sistema imune do hospedeiro. Dessa forma, além de importantes marcadores tumorais, estes antígenos tumorais são potenciais alvos terapêuticos.
Anticorpos monoclonais (mAbs, na sigla em inglês) são anticorpos produzidos por um único clone de um linfócito B, sendo, portanto, idênticos em relação às suas propriedades físico-químicas e biológicas. Diferentes tipos de mAbs podem ser gerados em laboratório para reconhecer e se ligar ao respectivo antígeno de interesse. Tal procedimento foi descrito pela primeira vez em 1975, em artigo publicado na revista Nature (“Continuous cultures of fused cells secreting antibody of predefined specificity”), pelos cientistas César Milstein e Georges Köhler. Por esse feito, ambos dividiram o Prêmio Nobel de Medicina no ano de 1984 com o dinamarquês Niels Kaj Jerne.
Os anticorpos monoclonais produzidos em laboratório são gerados a partir de linfócitos B isolados de camundongos cujos sistemas imunológicos foram estimulados pelo antígeno de interesse. Para melhorar a vida útil de produção da produção do mAbs, os linfócitos isolados são fundidos com células de mieloma, produzindo os chamados hibridomas. Uma vez triados e devidamente mantidos e armazenados, cada um destes hibridomas poderá garantir a produção, de um mAb murino específico e alta qualidade. Contudo, devido à sua origem murina, esses anticorpos, se usados de forma continuada durante uma terapia, estimulam uma reação imunológica ao próprio anticorpo, isto é, produção de anticorpos anti-drogas (ADAs), que, além de inativar a o efeito terapêutico, podem induzir a eventos adversos. Por essa razão, o uso dos mAbs ficou limitado durante duas décadas à produção de kits para diagnósticos ou à pesquisa científica.
 O obstáculo dessa imunogenicidade causada pelos mAbs começou a ser contornada com o avanço da biotecnologia e engenharia genética. Diferentes estratégias têm sido desenvolvidas para se obter mAbs cada vez mais “humanizados”, onde porções do anticorpo murino, que induzem à imunogenicidade, são substituídos por sequências proteicas humanas. Atualmente existem vários mAbs aprovados pelo FDA como moléculas terapêuticas e que estão associados a diferentes níveis de “humanização”.
O obstáculo dessa imunogenicidade causada pelos mAbs começou a ser contornada com o avanço da biotecnologia e engenharia genética. Diferentes estratégias têm sido desenvolvidas para se obter mAbs cada vez mais “humanizados”, onde porções do anticorpo murino, que induzem à imunogenicidade, são substituídos por sequências proteicas humanas. Atualmente existem vários mAbs aprovados pelo FDA como moléculas terapêuticas e que estão associados a diferentes níveis de “humanização”.
De modo geral, a premissa do processo de humanização é reduzir o risco de provocar efeitos adversos, sem alterar a afinidade do anticorpo pelo respectivo antígeno. Atualmente, já é possível criar anticorpos monoclonais completamente humanos, utilizando principalmente duas técnicas distintas, uma baseada em camundongos transgênicos e outra, na tecnologia de phage display (técnica de biologia molecular, que permite selecionar e isolar vetores de clonagem gerados a partir de bibliotecas genômicas).
Por mais de 20 anos, mAbs têm marcado importante presença no tratamento de diversos tipos de câncer. Os mAbs antitumorais podem atuar por meio de vários mecanismos: por ação direta, reconhecendo antígenos tumores-específicos e modificando a resposta do hospedeiro às células malignas, ou; de forma indireta sob a forma de ADCs (Antibody Drug Conjugates), carregando radioisótopos ou toxinas às células tumorais, ampliando seu espectro de aplicação terapêutica. Mais recentemente na área da oncologia, uma nova alternativa tem movimentado muito o campo farmacêutico e trazido resultados inovadores e envolve ação tanto direta como indireta de mAbs sobre o tumor. Os inibidores de pontos de verificação ou checkpoints do sistema imune são mAbs, que têm como alvo moléculas moduladoras do próprio sistema imunológico. Estas moléculas, como CTLA-4, PD-1, IDO, LAG-3, são mecanismos fundamentais de segurança, prevenindo eventos adversos autoimunes quando células do sistema imune estão atuando contra uma doença ou infecção.
 Descobriu-se, no entanto, que células tumorais se utilizam frequentemente destas moléculas de checkpoint para suprimir ou evadir do ataque do sistema imunológico, permanecendo “invisíveis”. Desta forma, o uso de inibidores de imuno-checkpoints visa superar uma das principais formas de defesa do câncer. Em 2011, o primeiro inibidor de imuno-checkpoint, anti-CTLA-4, foi aprovado pelo FDA para pacientes de melanoma metastático e, desde então, novas indicações e outros alvos vêm sendo avaliados. Contudo, há muito espaço para inovações e aprimoramentos, principalmente quanto à etapa de desenvolvimento destas drogas, que reflete diretamente no custo do tratamento.
Descobriu-se, no entanto, que células tumorais se utilizam frequentemente destas moléculas de checkpoint para suprimir ou evadir do ataque do sistema imunológico, permanecendo “invisíveis”. Desta forma, o uso de inibidores de imuno-checkpoints visa superar uma das principais formas de defesa do câncer. Em 2011, o primeiro inibidor de imuno-checkpoint, anti-CTLA-4, foi aprovado pelo FDA para pacientes de melanoma metastático e, desde então, novas indicações e outros alvos vêm sendo avaliados. Contudo, há muito espaço para inovações e aprimoramentos, principalmente quanto à etapa de desenvolvimento destas drogas, que reflete diretamente no custo do tratamento.
No Brasil, a ReceptaBio está desenvolvendo um projeto de mAbs imunoterapêuticos com grande potencial para o tratamento do câncer e que inclui a realização de testes clínicos no país.
Os ensaios clínicos em andamento com esses Mabs estão sendo conduzidos pela Agenus, parceira da ReceptaBio nos Estados Unidos, e registrados no clinicaltrials.gov como: NCT02694822, NCT03104699, NCT03411473 e NCT03495882.
Além do reconhecimento anterior pela revista Science como o “Avanço do Ano” em 2013, a imunoterapia recebeu o Prêmio Nobel de Medicina em 2018, através de dois pesquisadores, James P. Allison e Tasuku Honjo. O primeiro, americano, teve importante papel nos estudos das moléculas anti-CTLA-4 e o segundo, japonês, teve seu papel no desenvolvimento dos compostos anti-PD-1.
Referências:
De Groot A.S.; Scott D.W. "Immunogenicity of protein therapeutics". Trends in Immunology. 28: 482–490. Weiner GJ. “Building better monoclonal antibody-based therapeutics”. Nat Rev Cancer. 2015 Jun;15(6):361-70. doi: 10.1038/nrc3930.